El médico con más pagos de una farmacéutica respalda dos de sus terapias, cuestionadas por su precio y eficacia
Bayer gastó más de 98.000 euros en pagos directos e indirectos a Jordi Bruix, especialista en cáncer de hígado. El laboratorio comercializa dos medicamentos contra la enfermedad que generan dudas sobre su utilidad real.
“El éxito del regorafenib en el carcinoma hepatocelular en un mundo de fracasos”. Así se titula un editorial sobre terapias contra el cáncer de hígado publicado hace unos meses por Jordi Bruix Tudó, pese a las dudas sobre este medicamento. El jefe de oncología hepática del IDIBAPS -Hospital Clínic de Barcelona encabeza la lista de 18 profesionales sanitarios que recibieron más de 50.000 euros de una única farmacéutica -en pagos directos e indirectos- durante 2017. La empresa que fabrica dicho tratamiento, Bayer, gastó en él más de 98.000 euros.
Pagos directos e indirectos de Bayer
 Las transferencias de valor son el dinero que los laboratorios destinan a las organizaciones y los profesionales sanitarios. En 2017, el 98% de los pagos a Jordi Bruix procedían de Bayer, que le destinó más 98.000 euros. Del total recibido, las cantidades corresponden en su mayor parte (76,26%) a honorarios por su participación como ponente, consultor o miembro del consejo asesor -según revela en sus publicaciones científicas. El resto de pagos (23,74%) son transferencias indirectas para sufragar gastos relacionados con servicios, abonos de cuotas, alojamientos y desplazamientos a congresos.
Las transferencias de valor son el dinero que los laboratorios destinan a las organizaciones y los profesionales sanitarios. En 2017, el 98% de los pagos a Jordi Bruix procedían de Bayer, que le destinó más 98.000 euros. Del total recibido, las cantidades corresponden en su mayor parte (76,26%) a honorarios por su participación como ponente, consultor o miembro del consejo asesor -según revela en sus publicaciones científicas. El resto de pagos (23,74%) son transferencias indirectas para sufragar gastos relacionados con servicios, abonos de cuotas, alojamientos y desplazamientos a congresos.
Esta es la primera vez que Jordi Bruix aparece en los informes de las transferencias de valor de la industria farmacéutica. En los documentos se detallan los datos de todos los médicos, algo que no era obligatorio hasta ahora. Sin embargo, en sus artículos científicos de 2015 y 2016, Bruix declaró tener relaciones con Bayer. La única referencia en las transferencias anteriores corresponde a Bruix Hepatología S.L., una empresa -ya extinguida- dedicada a la asesoría médica. La compañía, cuyo administrador único y liquidador era el propio Jordi Bruix, obtuvo de Bayer 500 y 8.477 euros en 2015 y 2016. Si durante ese tiempo recibió más dinero de forma directa -algo que no es posible verificar-, significaría que prefirió que las transferencias a su nombre quedasen ocultas.
Jordi Bruix, que ha aparecido entre los científicos más citados del mundo, es uno de los mayores expertos internacionales en un tipo de cáncer de hígado llamado carcinoma hepatocelular. Esta enfermedad es la tercera causa de muerte por cáncer a nivel mundial. Fue él precisamente quien lideró la investigación clínica sobre el regorafenib (Stivarga) de Bayer, indicado para esta afección. A pesar de que Bruix hablase de “éxito”, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) rechazó en febrero financiar el regorafenib. ¿Las razones? El informe de posicionamiento terapéutico, publicado hace unos días, dice que el fármaco tiene una “relevancia clínica modesta”. Una postura criticada por Bruix, quien afirmó recientemente “que para el paciente no es buena la noticia”.
Conflictos de intereses y riesgos de sesgos
Las relaciones entre los profesionales y la industria farmacéutica se justifican por la necesidad de investigar y desarrollar nuevos medicamentos. Pero las transferencias a título personal generan serias dudas. “Si recibes mucho dinero de un fabricante, podrías no estar viendo sus productos de manera tan imparcial como lo harías si no recibieras ese dinero. Esa es la preocupación”, explicó el oncólogo Vinay Prasad en una entrevista con Technology Review. Que la imparcialidad de un especialista pueda verse afectada por estas colaboraciones es un problema reconocido en Estados Unidos, donde se aboga por la máxima transparencia posible para minimizar los riesgos. En España, a diferencia de lo que sucede con los altos cargos, los conflictos de intereses en el ámbito de la sanidad han pasado ampliamente desapercibidos para la opinión pública.
El regorafenib fue aprobado el año pasado tanto en Estados Unidos como en Europa. Según un artículo de los médicos Bishal Gyawali y Vinay Prasad, su eficacia fue demostrada en “grupos ideales de pacientes”. Es decir, en personas que tenían cáncer hepático, pero con un hígado en buen estado y sin síntomas graves de la enfermedad. “El estudio que llevó a la aprobación [el liderado por Bruix] tuvo muchos defectos”, asegura a Civio Bishal Gyawali, oncólogo de la Facultad de Medicina de Harvard. El regorafenib mostró un beneficio en la supervivencia de 2-3 meses frente al uso del placebo.
Esta no es la única crítica. El regorafenib es muy parecido a otro medicamento de Bayer aprobado hace una década. Además, ambas terapias presentan un beneficio limitado, un coste elevado y una toxicidad considerable. Civio ha intentado -sin éxito- conocer la opinión de Jordi Bruix sobre estos aspectos. En 2017, el especialista sí incluyó sus valoraciones en varias notas de prensa de Bayer sobre el regorafenib. En los comunicados, publicados en abril, mayo y agosto, consta que fue el investigador principal de los ensayos clínicos y que trabaja en entidades públicas. La farmacéutica también contó con la opinión de Bruix en notas de prensa de años anteriores sobre el regorafenib y el primer medicamento con el que guarda parecido. Pero ¿cuáles son las dudas detrás de estas terapias?
Dos fármacos contra el cáncer prácticamente iguales
El regorafenib es muy similar a otro medicamento de Bayer, el sorafenib (Nexavar). Su gran parecido, con un mecanismo de acción semejante, les ha valido el reconocimiento como me-too drugs. Los también llamados medicamentos de imitación son terapias muy discutidas, ya que mientras algunos critican su limitada innovación, otros defienden que sí aportan valor. En 2017, Bayer ganó a nivel mundial 834 y 315 millones de euros gracias al sorafenib y al regorafenib, que se situaron entre sus fármacos más vendidos. Su investigación clínica fue liderada por el propio Bruix.
El primer medicamento, el sorafenib, fue autorizado en Estados Unidos y Europa hace una década, en un momento en el que no existía ningún otro tratamiento sistémico contra este cáncer de hígado. El equipo de Jordi Bruix, junto a otros colaboradores, probó que el sorafenib ofrecía un beneficio en la supervivencia de 2-3 meses frente al placebo, el mismo período de tiempo que después mostró el regorafenib. “El beneficio del sorafenib en el mundo real es mucho menor de lo que fue visto en el ensayo clínico”, explica Gyawali, citando las conclusiones de una investigación realizada en Estados Unidos. Ante las críticas sobre el “beneficio marginal” del sorafenib, Bruix ha defendido en congresos científicos que sucede lo mismo con otras terapias oncológicas.
Sorafenib (Nexavar)
Regorafenib (Stivarga)
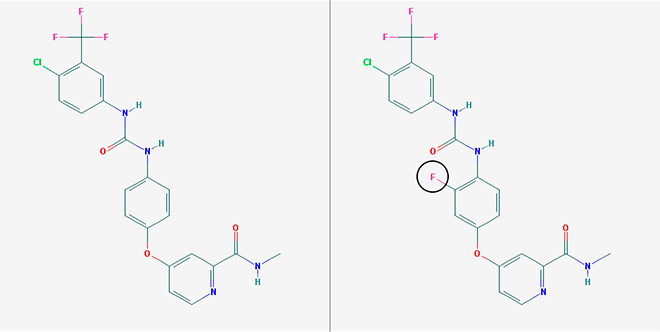
La estructura química de los dos medicamentos es prácticamente igual: solo se diferencian en un átomo (señalado en un círculo). Fuente de las imágenes: PubChem - Open Chemistry Database
Gyawali, muy crítico con el desarrollo de estos tratamientos, reprocha además que el segundo fármaco, el regorafenib, no fuera comparado con el sorafenib durante su investigación clínica. Los medicamentos “me-too” suelen ser evaluados únicamente frente al placebo y no con el otro tratamiento con el que guardan parecido, según denunció en 2004 Marcia Angell, una profesora de la Universidad de Harvard bastante crítica con la industria.
Los dos medicamentos de Bayer están autorizados como terapia contra el cáncer de hígado, cuyas opciones de tratamiento en fase avanzada son muy reducidas. En el caso del sorafenib, las guías de la Asociación Europea del Estudio del Hígado (EASL, en inglés) -en las que colaboró Bruix en el pasado- recomiendan su uso en algunos pacientes con cáncer que cumplan condiciones específicas. Por ejemplo, que su hígado se encuentre en buen estado o que su calidad de vida no haya empeorado mucho. Para la EASL, los resultados positivos del sorafenib abrieron la puerta hacia la evaluación de otras terapias. Por su parte, el regorafenib está indicado en los casos de pacientes con cáncer de hígado en fase avanzada que hayan empeorado -y que hubieran recibido previamente sorafenib.
Medicamentos caros y cuestionados
Pese al éxito logrado por Bayer con el sorafenib hace una década -y más recientemente con el regorafenib-, hoy algunos expertos ponen en duda que superen los análisis de coste-efectividad. “Muchos estudios demuestran que no”, dice a Civio Gyawali, en referencia al sorafenib (Nexavar). En España, el precio de cada caja, con 112 comprimidos de 200 mg, supera los 3.000 euros. Los pacientes toman cuatro pastillas al día. El coste del regorafenib (Stivarga) es menor: cada envase, con 84 comprimidos de 40 mg, vale unos 1.900 euros aproximadamente. Los pacientes también reciben cuatro pastillas de regorafenib al día durante tres semanas, seguidas de otra semana de descanso. Su precio no es el único factor en entredicho.
“Lo que es cuestionable es si el beneficio que se obtiene en la supervivencia justifica asumir su perfil de seguridad (efectos adversos) y el coste”
“Lo que es cuestionable”, apunta otro experto en hepatología -que prefiere mantenerse en el anonimato-, es “si el beneficio [del sorafenib] que se obtiene en la supervivencia justifica asumir su perfil de seguridad (efectos adversos) y el coste”. Aunque en un principio tuvo buena acogida y hoy se considera un tratamiento estándar contra estos tumores, después de su autorización se ha probado la existencia de efectos secundarios intensos, que pueden limitar su aplicación en clínica.
A la hora de valorar unos tratamientos ya aprobados, los hepatólogos consultados coinciden en que la situación en muchas ocasiones no es sencilla. En ese contexto, donde no hay otra opción, los pacientes han de elegir entre dos caminos muy duros: recibir un fármaco, como el sorafenib, que puede producir una ligera mejora en su supervivencia -a costa, probablemente, de unos efectos adversos importantes que empeorarían su calidad de vida- u optar por un tratamiento paliativo.

Conan | Flickr
Las dudas sobre el coste-efectividad del sorafenib (Nexavar) se han planteado también en otros países como Reino Unido. Allí su organismo regulador (NICE) rechazó en un principio la utilización rutinaria del sorafenib por el alto precio y el limitado beneficio que aporta. En 2017, cuando Bayer ofreció un precio más barato, el NICE dio luz verde al medicamento. Su coste, según The Guardian, es mayor en el país anglosajón que en España.
¿Cuáles son las opiniones acerca del segundo medicamento de Bayer? “En todos los aspectos el regorafenib es peor”, sentencia Gyawali. El oncólogo censura su toxicidad, descrita por la Agencia Española de Medicamentos como “problemática”, teniendo en cuenta que ha de ser administrado a personas con cáncer en fase avanzada. Un escenario, según su informe, en el que “preservar la calidad de vida del paciente es de gran importancia”, por lo que han de valorar tanto la eficacia como sus posibles efectos tóxicos dado que “se busca un efecto paliativo”. El NICE de Reino Unido también ha rechazado su utilización rutinaria dado que el regorafenib parece no ser coste-efectivo.
Expertos con influencia en medicina
El equipo liderado por Jordi Bruix, el Barcelona Clinic Liver Cancer (BCLC), cuenta con un gran reconocimiento internacional en la investigación de estos tumores. Además, en su grupo hay otra especialista que mantiene vínculos con Bayer. Se trata de María Elisa Reig Monzón, quien firmó junto a Bruix el editorial sobre el “éxito” del regorafenib. La investigadora también aparece entre los 18 profesionales sanitarios que más dinero recibieron de una única farmacéutica en 2017.
Una investigadora del mismo equipo de Bruix también recibió transferencias de Bayer
 María Reig, que realizó la tesis -dirigida por Bruix- sobre el sorafenib en cáncer de hígado, es investigadora postdoctoral del IDIBAPS. Bayer gastó en ella más de 72.000 euros, lo que representa un 96% de sus transferencias. Del total recibido, la mayor parte corresponde (71,93%) a honorarios y el resto (28,07%) a pagos indirectos. Sus datos tampoco constan en la lista de transferencias de Bayer anteriores a 2017, cuando no era obligatorio, aunque en sus publicaciones científicas de 2015 y 2016 sí cita sus vínculos con la farmacéutica.
María Reig, que realizó la tesis -dirigida por Bruix- sobre el sorafenib en cáncer de hígado, es investigadora postdoctoral del IDIBAPS. Bayer gastó en ella más de 72.000 euros, lo que representa un 96% de sus transferencias. Del total recibido, la mayor parte corresponde (71,93%) a honorarios y el resto (28,07%) a pagos indirectos. Sus datos tampoco constan en la lista de transferencias de Bayer anteriores a 2017, cuando no era obligatorio, aunque en sus publicaciones científicas de 2015 y 2016 sí cita sus vínculos con la farmacéutica.
Según explica a Civio el IDIBAPS -vinculado al Hospital Clínic de Barcelona-, dado que “los ensayos clínicos que demostraron su eficacia [del sorafenib y del regorafenib] se lideraron desde su hospital”, “es lógico” que Bayer “financie su participación en actividades de transmisión de este conocimiento y lo comunique en su página web, como es preceptivo”. Que las empresas privadas recurran a expertos de la comunidad médica para este tipo de acciones de difusión ha sido muy discutido en otros países.
Quiénes son Jordi Bruix y María Reig
En el argot de la industria, los especialistas internacionales como Bruix y Reig son conocidos con el nombre de líder de opinión (key opinion leader o KOL, en inglés). “Las farmacéuticas utilizan el término [para referirse] a cualquier médico o investigador con el que tienen relación”, explica a Civio Sergio Sismondo, profesor de la Universidad de Queen. “Cuando se hace referencia a alguien como KOL significa que la investigación y el marketing se han juntado en al menos algunas de las actividades de esa persona”, añade.
Líder de opinión, una polémica figura en investigación
En los años cincuenta, Pfizer comprobó que era más efectivo recurrir a profesionales de reconocido prestigio dentro de la comunidad médica para difundir sus mensajes que valerse de trabajadores de la propia compañía. Hoy en día, algunos profesionales defienden que los líderes de opinión son expertos independientes que asesoran a las compañías, mientras que otros denuncian que las empresas solo apelan a estos especialistas por intereses comerciales.
Bruix y Reig firman por separado o de manera conjunta numerosos artículos y revisiones como expertos en la materia. Los dos han mantenido vínculos económicos con Bayer, que constan -salvo excepciones- en sus publicaciones científicas. Sin embargo, estas relaciones solo se han desvelado en los informes sobre las transferencias de valor de 2017, cuando comenzó a ser obligatorio. Pese a las críticas, los dos facultativos respaldan las terapias de Bayer, aunque existen dudas importantes sobre si su limitado beneficio justifica aceptar sus efectos adversos y su precio.
Metodología
Han participado en el análisis y limpieza de datos necesarios para esta investigación María Álvarez del Vayo, Miguel Ángel Gavilanes, Eva Belmonte, David Cabo, Javier de Vega, Amir Campos y Raúl Díaz Poblete.
Además de las personas entrevistadas para el artículo, Civio ha intentado contactar en múltiples ocasiones con Jordi Bruix y María Reig. Solo hemos recibido respuestas generales, a través del Gabinete de Comunicación del Instituto de Investigaciones Biomédicas August Pi i Sunyer (IDIBAPS), sobre la publicación de las transferencias y de los conflictos de intereses, sin poder entrevistarles directamente. Tampoco hemos recibido respuesta de otros especialistas como Carl Elliott, Charlie Buckwell y Marcia Angell. Los dos hepatólogos españoles han preferido mantenerse en el anonimato.
Por último, hemos preguntado a Bayer cómo se realizan los comunicados de prensa donde aparecen investigadores públicos citados, sin recibir respuesta por el momento. Los precios por caja -sin IVA- de los medicamentos Nexavar (sorafenib) y Stivarga (regorafenib) se han extraído de las adjudicaciones por adquisición de fármacos que han realizado los sistemas de salud de Canarias -para el Nexavar y para el Stivarga-, Asturias y País Vasco -para el Nexavar.
Déjanos decirte algo…
En esta información, y en todo lo que puedes leer en Civio.es, ponemos todo el conocimiento acumulado de años investigando lo público, lo que nos afecta a todos y todas. Desde la sociedad civil, 100% independientes y sin ánimo de lucro. Sin escatimar en tiempo ni esfuerzo. Solo porque alguien tiene que hacerlo.
Si podemos informar así, y que cualquiera pueda acceder sin coste, sin barreras y sin anunciantes es porque detrás de Civio hay personas comprometidas con el periodismo útil, vigilante y al servicio de la sociedad en que creemos, y que nos gustaría seguir haciendo. Pero, para eso, necesitamos más personas comprometidas que nos lean. Necesitamos socios y socias. Únete hoy a un proyecto del que sentir orgullo.
Podrás deducirte hasta un 80% de tu aportación y cancelar cuando quieras.
¿Aún no es el momento? Apúntate a nuestro boletín gratuito.
